Por: Betty Beatón Ruíz
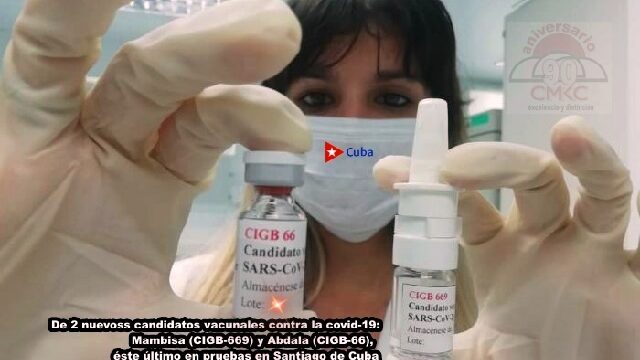
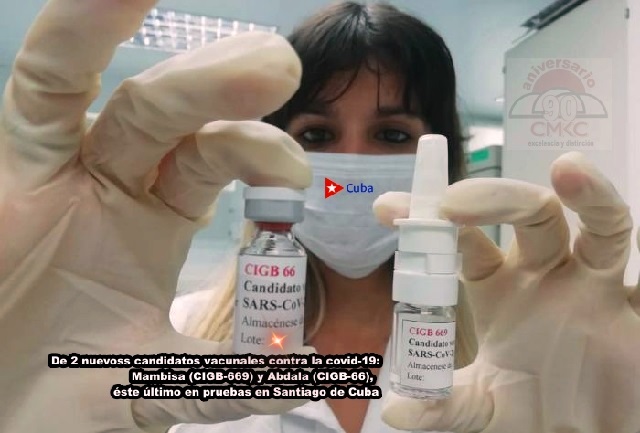
Abdala.- Hoy, primer día del segundo mes del año 2021 marca el inicio de la segunda etapa del ensayo clínico de Abdala, contra la COVID-19, hecho que aviva la confianza en los aportes de la ciencia cubana en el enfrentamiento a la pandemia que azota a la humanidad.
Cuba readies 100 million doses of anti-COVID vaccine
Abdala en II Fase de Ensayo Clínico a partir de mañana en Santiago de Cuba
Abdala.- En la suroriental provincia de Santiago de Cuba, única del país donde se realizan los estudios vinculados a la eficacia de ese candidato vacunal, unos 800 voluntarios, entre hombres y mujeres, previamente seleccionados en diferentes centros laborales y de estudios, están listos para dar continuidad a un proceso que comenzó el pasado diciembre.

y Quédate en Casa!, sugiere CMKC
El ensayo clínico del candidato vacunal Abdala también va siendo favorable
Abdala- Según precisó el Dr. Rafael Suárez Domínguez, director del Hospital provincial Saturnino Lora, institución donde se realiza la prueba clínica, el nuevo momento cuenta con la aprobación de prestigiosos evaluadores y supervisores, entre ellos el .
Abdala en II Fase de Ensayo Clínico a partir de mañana en Santiago de Cuba
Avanza estudio fase I en convalecientes con candidato vacunal Soberana 01
Abdala, fruto de la constancia de investigadores del Centro de Ingeniería Genética y Biotecnología (CIGB), es uno de los cuatro candidatos vacunales que se ensayan en Cuba contra el SARS COV2.
Es de Cuba Soberana, el primer candidato vacunal de América Latina y el Caribe contra la COVID-19
Abdala en II Fase de Ensayo Clínico a partir de mañana en Santiago de Cuba

Confirman seguridad de los candidatos vacunales Abdala y Mambisa
Profesionales del “Saturnino Lora” unen talento y esfuerzos al quehacer de sus colegas del CIGB para materializar con éxito este ensayo, lo que incluye el chequeo y seguimiento a los voluntarios que participaron en la primera fase.
Van bien 4 candidatos vacunales cubanos, gracias a la ciencia contra la covid-19
Abdala en II Fase de Ensayo Clínico a partir de mañana en Santiago de Cuba

#MINSAP#OPS#Cuba
Exponen avances de los cuatro candidatos vacunales de Cuba
Este viernes, se llevó a cabo una sesión técnica conjunta entre el #MINSAP y la Organización Panamericana de la Salud #OPS donde se expusieron los avances de los cuatro candidatos vacunales contra la Covid-19 de #Cuba. Con el reporte, la periodista Gisela García
Inicia Santiago de Cuba ensayo del Candidato Vacunal “ABDALA” contra la COVID-19
Más relacionado con el tema:

Declaración del CECMED,
al inicio de la actual pandemia:
En el contexto mundial que se nos presenta con la pandemia del nuevo coronavirus, el CECMED, en cumplimiento de su rol esencial para promover y proteger la salud pública, a través de un sistema regulador capaz de garantizar el acceso oportuno al mercado de productos con calidad, seguridad, eficacia e información veraz para su uso racional, incluso en situaciones de emergencias de salud pública, establece las medidas pertinentes para mitigar las consecuencias que puede traer consigo esta pandemia, en cuanto al impacto en la cadena de suministro, escasez de productos médicos o interrupciones en su investigación y desarrollo.
A tales efectos dispone:
- Mantener la vitalidad del CECMED como Autoridad Reguladora Nacional de Medicamentos, Equipos y Dispositivos Médicos, de modo que cumpla con sus funciones para garantizar la salud de la población, en cualquier etapa de la pandemia del coronavirus.
- Priorizar la evaluación y aprobación de los trámites que se presenten de medicamentos, equipos y dispositivos médicos, para diagnosticar, tratar y prevenir la pandemia de coronavirus.
- Dar máxima prioridad a la evaluación de cualquier tecnología sanitaria que se pretenda proponer o introducir para prevenir o tratar la COVID-19.
- Priorizar la evaluación de cualquier propuesta de producto natural o terapia complementaria, que pueda constituir una alternativa para prevenir o dar solución al COVID-19.
- Otorgar permisos excepcionales, en casos de emergencias, a medicamentos y diagnosticadores, según establece el artículo 100 del Reglamento para el Registro Sanitario de Medicamentos del CECMED y el Registro Sanitario de Diagnosticadores, relacionados con el diagnóstico, la ayuda al diagnóstico o seguimiento del coronavirus.
- Otorgar las prórrogas solicitadas para la presentación de las renovaciones de los registros sanitarios u otros trámites, según sea necesario.
- Priorizar la evaluación y dictamen de solicitudes de autorización excepcional, ante dificultades que se puedan presentar en el cumplimiento de lo declarado en los Registros Sanitarios.
- Ejecutar el proceso de liberación de lotes de manera acelerada y expedita para productos biológicos y diagnosticadores que lo requieran.
- Priorizar la evaluación y aprobación de autorizo o modificación de ensayos clínicos que propongan el uso de nuevos medicamentos o estrategias para el tratamiento y prevención de la pandemia del coronavirus.
- Priorizar y aprobar de manera inmediata cualquier trámite de importación relacionado con medicamentos o productos sanitarios necesarios para enfrentar a la COVID-19, de no existir riesgos asociados.
- Aprobar con carácter transitorio, la modificación de los requisitos del “Reglamento sobre el Sistema de Licencias Sanitarias de Operaciones Farmacéuticas (LSOF) y la Certificación de las Buenas Prácticas de Fabricación” (BPF), del “Reglamento del Sistema de Licencias Sanitarias para Operaciones con Diagnosticadores” y del “Reglamento para la Certificación de Buenas Prácticas en los Laboratorios Clínicos”, que establecen la prolongación de los tiempos de evaluación de los trámites de inspección recibidos y la extensión de las Licencias Sanitarias y Certificaciones de Buenas Prácticas vigentes hasta el 31 de agosto de 2020 (se extenderán hasta el 31 de octubre), garantizando así que los establecimientos mantengan su condición actual y que hasta pasado el mes de agosto no se realicen inspecciones, a no ser que se requieran por necesidades impostergables de la pandemia o del país.
- Establecer mecanismos de vigilancia activa y proactiva para medicamentos, equipos y dispositivos médicos que se aprueben en el tratamiento de la COVID-19 o sus complicaciones, que no posean los datos de seguridad o efectividad suficientes, o que sean de nueva introducción, para comprobar y asegurar una relación beneficio/riesgo favorable.
- Priorizar la vigilancia sobre los equipos que emplean radiaciones ionizantes para el diagnóstico y tratamiento, de manera que se cumplan sus parámetros de efectividad y seguridad en el uso clínico.
- Facilitar de forma acelerada la autorización de donaciones relacionadas con la epidemia, así como la evaluación y aprobación de importación o exportación de muestras biológicas.
- Aprobar, con carácter transitorio, la modificación de los requisitos del “Reglamento para la Evaluación y el Control Estatal de Equipos Médicos”, que establece la posposición de las auditorías regulatorias que se requieran, como parte de los procesos de inscripciones de fabricantes, suministradores e importadores de equipos y dispositivos médicos en curso o que estén vigentes hasta el 15 de mayo, las cuales se ejecutarán una vez que las condiciones del país lo permitan. Extender la vigencia de los Certificados de Buenas Prácticas de Fabricación de equipos y dispositivos médicos y de Libre Venta hasta el 31 de octubre de 2020.
- Establecer, mediante la Oficina de Innovación del CECMED, una estrategia regulatoria que incluya la asesoría, orientación y asistencia técnica reglamentaria para avanzar en el desarrollo y la disponibilidad de vacunas, terapias y pruebas de diagnóstico para este nuevo virus.
- Colaborar y asesorar a otras instituciones y organizaciones que lo necesiten e intervengan en el enfrentamiento a la pandemia, como parte de las acciones que realiza el país: BioCubaFarma, el MININT, Laboratorios Clínicos, la Aduana General de la República, importadores y otros.
- Emitir otras disposiciones transitorias, en los casos que se requieran.
CECMED, La Habana 23 de marzo de 2020.

Abdala en II Fase de Ensayo Clínico a partir de mañana en Santiago de Cuba























